Science| 阐明溶酶体靶向嵌合体靶向降解膜蛋白的细胞决定因素大家好,今天给大家分享的是2023年10月发表在Science上的“Elucidating the cellular determinants of targeted membrane protein degradation by lysosome-targeting chimeras”。通讯作者:该研究论文的通讯作者为斯坦福大学Steven M. Banik助理教授和Carolyn R. Bertozzi教授。继2020年在Nature上首次发表溶酶体靶向嵌合体(LYTAC)分子后,该团队首次阐释了影响LYTAC降解膜蛋白的细胞决定因素。课题组网站:https://bertozzigroup.stanford.edu/。研究背景:单个蛋白质的选择性去除可调节多种疾病的驱动靶标,作为细胞内蛋白降解的一种方法,PROTAC已被证明其临床效果。PROTAC具有独特的优势,但是也存在明显的短板。比如,PROTAC的靶点通常是胞内蛋白,而对分泌蛋白和细胞膜蛋白则束手无策。许多疾病相关的治疗靶点属于分泌蛋白(胞外)和膜相关蛋白,这两类蛋白占人类蛋白质组的40%。2020年,斯坦福大学的Bertozzi 教授团队在Nature上曾报道其开创的新的蛋白降解技术——溶酶体靶向嵌合体(LYTACs)可以识别细胞外或细胞膜表面蛋白从而介导其降解,该技术能够弥补蛋白水解靶向嵌合体(PROTAC)只能靶向细胞内蛋白的空缺。LYTACs通过调控细胞表面受体CI-M6PR(非阳离子依赖型甘露糖-6-磷酸受体)在细胞质膜和溶酶体之间运输特定蛋白质。然而这项新技术如何调控溶酶体蛋白运输从而降解胞外或膜蛋白质的机制尚不清楚。细胞膜蛋白的降解通常是通过溶酶体途经完成,如EGF引起的EGFR降解过程。溶酶体靶向嵌合体(LYTAC)是一种双功能分子,具有两个结合域,可以同时结合胞外蛋白或膜蛋白的胞外结构域,以及细胞表面的溶酶体靶向受体(TLR),形成三元复合物,例如,阳离子非依赖性甘露糖 6–磷酸受体(CI-M6PR)(图)。此后,通过内吞作用导致蛋白质的内化与降解,形成一个运输囊泡,囊泡会将复合物运输到溶酶体中,并最终降解靶蛋白。
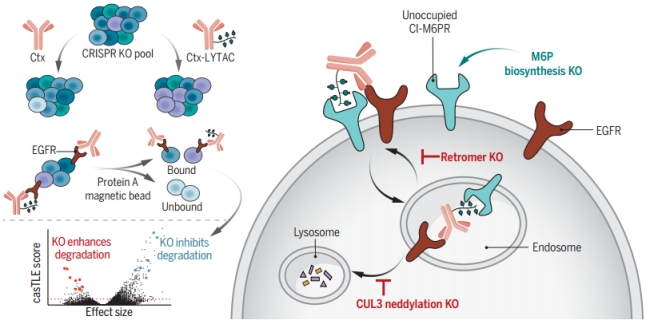
图片摘要:鉴定LYTAC介导的膜蛋白降解的细胞决定因素
研究内容:1. 包含抗体-糖肽偶联物的下一代 LYTAC 的设计。为了推动机理研究,研究团队首先开发了合成可扩展的下一代LYTAC分子。鉴于第一代LYTAC分子M6Pn-糖聚合物的异质性可能导致批次间差异和阻碍LYTAC分子精确分子性质的表征,研究人员开发了均相肽,并将其融入标准固相肽合成工作流程中,以便更好地控制抗体-肽偶联物的结构组成(图1B)。CTX-M6Pn5和 Ctx-M6Pn2在UMRC2和HeLa细胞中降解了~80%的细胞表面EGFR(图1C)。为了扩大靶向膜蛋白的范围,团队将肽分别与吉伦妥昔单抗(Gir)和奥那珠单抗(Ona)偶联,这两种抗体分别针对碳酸酐酶IX(CA9)和c-Met。GIR-M6Pn5和Gir-M6Pn2在UMRC2细胞中能够降解大于80%的表面CA9,在U87MG细胞中降解70%至80%(图1D)。他们证实Gir-M6Pn2降解了CA9(图1E),通过定量蛋白质组学证明CA9的下调具有高度选择性(图1F)。最后,团队通过验证可以同时降解两个不同的膜靶点证明了CI-M6PR诱导的降解不存在容量限制(图1G)。
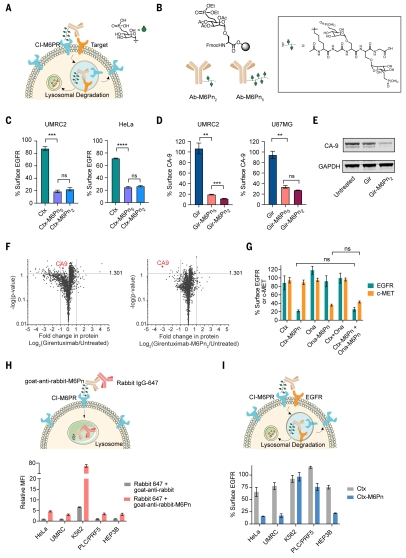
图1. 包含抗体-糖肽偶联物的LYTAC能够降解膜靶标2. 基于磁性细胞分选的全基因组CRISPR筛选,确定LYTAC介导的降解的关键调节因子。为了深入研究膜蛋白降解,团队设计了一种使用磁富集的全基因组CRISPR缺失筛选方法。首先,作者构建了用全基因组单向导RNA(sgRNA)敲除文库感染的UMRC2-Cas9细胞,并分别用Ctx或Ctx-M6Pn处理这些细胞。随后,作者利用蛋白A磁珠来分离EGFR阳性细胞和阴性细胞。当用 Ctx-M6Pn 处理通过 CRISPR 介导的基因敲除细胞时,失去降解 EGFR 能力的细胞会保留在结合部分中,而失去细胞表面 EGFR 的细胞保留在未结合部分。通过下一代测序分析这些富集的组分,以确定 LYTAC 介导的膜蛋白降解所需的基因(图2A)。通过分析,作者团队发现“逆转录复合物”、“CUL3-RING 泛素连接酶”和“蛋白neddylation”是 LYTAC 介导的 EGFR 降解的富集特异性途径(图2C)。内质网(ER)和高尔基体中逆转录复合体复合物、neddylation途径和M6P生物合成相关的基因均对LYTAC介导的降解有显著影响,但没有明确的机制基础。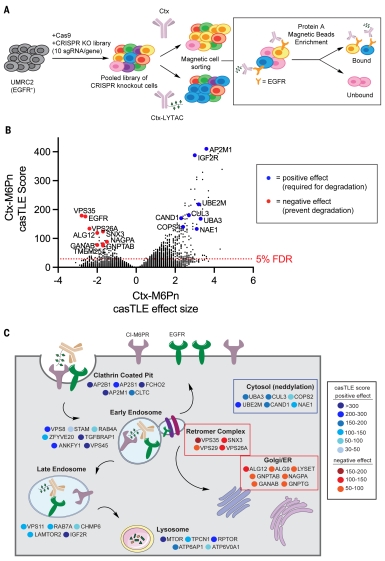
图2. 全基因组CRISPR KO筛选鉴定LYTAC介导的膜蛋白降解的调节因子。
3.逆转录复合物基因的破坏通过减少从内体到质膜的再循环来增强 LYTAC 介导的降解。逆转录复合体参与从内体向反式高尔基体网络(TGN)或质膜的逆行运输。逆转录蛋白复合物的核心成分,如液泡蛋白分选相关蛋白 35 (VPS35)、液泡蛋白分选相关蛋白 26A (VPS26A)、分选连接蛋白 3 (SNX3) 和液泡蛋白排序相关蛋白 29 (VPS29),从筛选中被鉴定为阴性相关因素(图3A)。团队探究了敲除这些基因是否会改善LYTAC介导的蛋白降解。结果显示,VPS26A 或 SNX3 缺陷细胞中 EGFR 的降解明显更大,这表明当逆转录基因被破坏时降解更有效(图3B, C)。共聚焦成像显示,EGFR定位于晚期内体或溶酶体(LE/LY)和野生型(WT)细胞的质膜上,而在LYTAC处理后,在VPS26A缺失细胞的细胞表面上大多检测不到EGFR,表明VPS26A的缺失不会改变CI-M6PR的表面表达水平(图3D)。由于逆转录复合物参与回收内体中的货物,因此在 LYTAC与受体解离之前,部分LYTAC-CI-M6PR复合物可被回收。WT细胞中,LYTAC定位于质膜并部分定位在LE / LY中,而没有观察到LYTAC在VPS26A KO细胞的细胞表面定位(图3F),因此团队得出结论:LYTAC可以通过逆转录复合物从内体回收回质膜,而当逆转录复合物中的组分被破坏时,这种回收就会减少。在WT和VPS26A缺陷细胞中,团队观察到Ctx仍然与细胞表面的EGFR结合(图3F和G),因此,团队认为在LYTAC与受体分离之前,逆转录酶复合物可以回收LYTAC–CI-M6PR复合物,并且逆转录酶基因的扰动可以通过去除CI-M6PR的竞争性回收途径来提高LYTAC的功效。
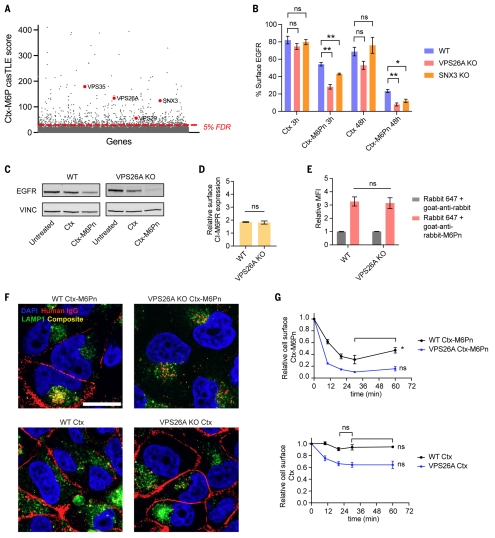
图3. 破坏逆转录酶复合物基因通过减少LYTAC–CI-M6PR复合物的循环来增强CI-M6PR介导的靶标降解。
4.CUL3 的类泛素化是LYTAC 介导的膜蛋白降解的关键和预测标志物。团队发现了几个相关性高的基因,这些基因参与了E3 连接酶 cullin-3 (CUL3) 的类泛素化和激活。在激活过程中,Nedd8 从E1转移到E2,然后转移到E3连接酶(CUL3)。失活的CUL3通常与CAND1结合,并且在类泛素化时,CAND1解离激活的CUL3(图4 A)。所有这些组分,包括 CUL3,都被鉴定为对 Ctx-M6Pn 介导的降解具有积极作用的因素,表 明CUL3的类泛素化对LYTAC介导的降解很重要(图 4B)。该通路中的基因(CUL3、UBA3、CAND1)的敲除证实EGFR 的降解依赖于功能性E3类泛素化系统(图4C)。在CUL3缺陷细胞中c-MET的降解也减弱了,表明CUL3的作用不是靶标特异性的(图4D)。团队还验证了CUL3的类泛素化对于内源性机制的EGFR下调是可有可无的,但对于LYTAC介导的EGFR降解是必需的(图4E)。此外,作者证明,在CUL3缺陷细胞中,LYTAC的结合和内化没有改变,因此CUL3 活性是 LYTAC 介导的内化的下游。为了进一步研究此效应,团队观察了 LYTAC 处理 72 小时后 EGFR 的定位,发现 EGFR 部分集中在 CUL3 缺陷细胞的 LE/LY 囊泡中,而 EGFR 在 WT 细胞中大部分被降解,这表明CUL3在LYTAC介导的靶标从内体成熟到溶酶体降解中起着重要作用(图F-J)。为了了解CUL3如何调节核内体向溶酶体的成熟,作者通过免疫共沉淀蛋白质组学鉴定了neddylated CUL3的相互作用分子,最显著的分子是SQSTM1(图4K和L)。在SQSTM1 KO细胞中,LYTAC降解EGFR的能力降低(图S18 B-D)。在CUL3 KO细胞中,SQSTM1与Ctx-M6Pn共定位(图4M)。CUL3 neddylation修饰对LYTAC活性的关键作用,因此作者比较了11种细胞系的类泛素化CUL3表达水平和EGFR降解能力,发现类泛素化CUL3表达水平较高的细胞系对EGFR的降解更好(图4N-P),表明类泛素化CUL3水平可以作为LYTAC介导的膜蛋白降解的预测标志物。
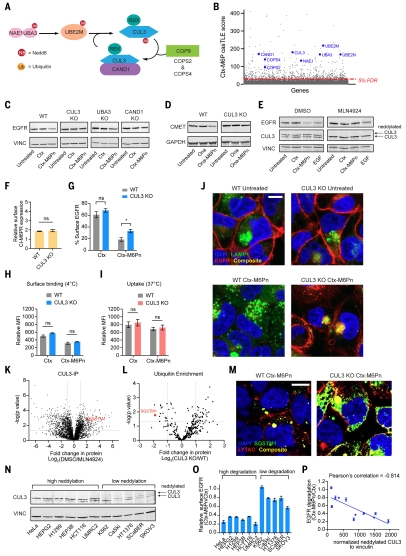
图4. CUL3的类泛素化对CI-M6PR介导的靶溶酶体降解至关重要。
5.M6P生物合成基因的破坏增强了LYTAC的功效。溶酶体水解酶在内质网中合成并转运到 TGN,在那里用 M6P 修饰。TGN 中的 CI-M6PR 可识别 M6P 修饰的溶酶体蛋白,并将其转运至晚期内体,最终实现溶酶体递送。团队鉴定了几种参与 M6P 糖蛋白生物合成途径的具有负效应的糖基转移酶,并鉴定了跨膜蛋白251(TMEM251)或溶酶体酶转运因子(LYSET)是M6P修饰和溶酶体水解酶转运的关键蛋白(图5 B)。Ctx-M6Pn 介导的降解在 ALG12 或 GNPTAB 缺陷细胞中增强(图5 C),共聚焦显微镜显示,在LYTAC处理后,一些EGFR仍保留在WT细胞的细胞表面,而在ALG12或GNPTAB缺陷的细胞中,EGFR几乎从细胞表面耗尽(图5D),这些细胞中,LYTAC处理后,没有检测到任何表面结合的EGFR,这表明靶标-LYTAC-CI-M6PR复合物的内化增强。经过验证,M6P生物合成的破坏增强了跨多个膜靶标的LYTAC活性。
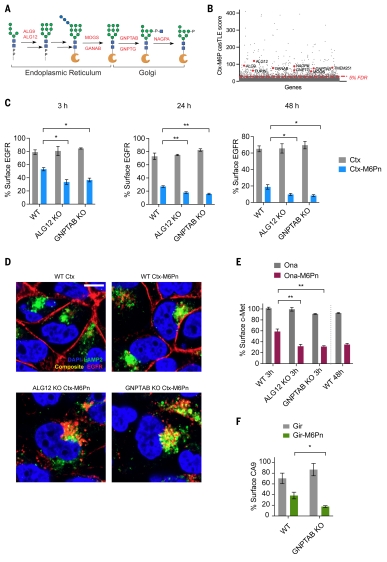
图5. 敲除M6P生物合成基因可增强LYTAC的功效。6. M6P生物合成减弱CI-M6PR细胞表面可及性为了阐明M6P生物合成基因的破坏如何提高LYTAC的功效,作者首先评估了摄取,ALG12和GNPTAB KO细胞的摄取显著增加,且内化的货物与溶酶体共定位(图6,a和B)。ALG12或GNPTAB缺失并未导致表面CI-M6PR表达的显著差异(图6C)。接着,作者检测了LYTAC与细胞表面的结合情况。在ALG12和GNPTAB KO的细胞中,LYTAC与细胞表面的结合较高,并且通过与抑制性单体M6P共同处理可减弱LYTAC与细胞表面的结合,这表明这种结合是CI-M6PR依赖的(图6D)。因此,CI-M6PR在稳态下被M6P修饰的蛋白占据。破坏M6P生物合成基因增加了细胞表面可结合的CI-M6PRs的比例,从而增强了LYTACs的内化(图6H)。
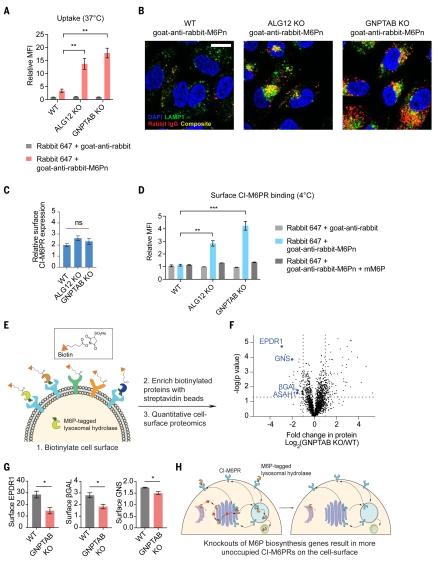
图6. M6P生物合成减弱了CI-M6PR细胞表面的可及性。
总结:在这项工作中,作者使用全基因组CRISPRs筛选机制研究了影响LYTAC降解膜蛋白的驱动因素及详细机制,筛选出了3条影响LYTAC降解效率的通路:(1)敲除逆转录复合物基因可阻碍LYTAC再循环到细胞质膜,从而增加靶向膜蛋白的降解。(2)CUL3类泛素化修饰可促进核内体向溶酶体转变,是LYTAC疗效的预测标志物。(3)抑制M6P生物合成可增强LYTAC靶标复合物的内化作用。这些机制的阐明为下一代LYTAC的设计提供了灵感。此外,该工作中揭示的受体再循环、占有率和穿越内溶酶体系统的能力,将会影响其他依赖细胞表面到溶酶体运输的治疗方法的发展,例如发展酶替代疗法、核酸递送和抗体药物偶联物等。
撰稿人:黄瑜婷
|