Nature|分室化眼部淋巴系统介导眼脑免疫 大家好,今天给大家分享的是2024年2月发表在Nature上的“Compartmentalized ocular lymphatic system mediates eye-brain immunity”。 通讯作者: 该研究论文的通讯作者为耶鲁大学的Eric Song。 研究概要: 眼睛是中枢神经系统(CNS)的解剖学延伸,与大脑有许多分子和细胞相似之处。新兴研究表明,大脑的变化通常反映在眼睛中,尤其是在视网膜中。尽管如此,眼后部和其他中枢神经系统组织之间免疫学联系的可能性仍未被探索。 单纯疱疹病毒(HSV)具有影响许多组织的倾向,包括多个神经组织,如背根神经节、眼睛和大脑,并且是全球散发性致命性脑炎的最常见病因。在研究大脑中对单纯疱疹病毒的免疫反应中,作者观察到玻璃体内免疫可以保护小鼠免受颅内病毒攻击。这种保护延伸到细菌甚至肿瘤。
眼睛的前部和后部存在不同的淋巴引流系统,后部通过视神经鞘中的淋巴管系统与脑膜淋巴管相连接,共享淋巴回路,在眼睛后部和大脑之间建立了统一的免疫反应。能够在后眼和大脑之间建立统一的免疫反应,突出了眼睛未被充分研究的免疫学特征,并为眼部和中枢神经系统疾病的开辟了新治疗策略。
研究内容: 1、后眼中的抗原在大脑中引起免疫反应 为了了解大脑中对HSV的保护性免疫,作者通过四种给药途径给小鼠接种热灭活HSV-2——腹腔内(ip)诱导全身免疫,颅内(ic)诱导局部脑免疫,前房内(AC)和玻璃体内(后房(IVT))——最后两种给药途径中的前房和玻璃体是与神经系统有独特解剖联系的眼隔间(图1a)。在致命的ic。 HSV-2攻击后,所有接受ip免疫的小鼠都死于感染,而ic免疫保护了大约80%的小鼠(图1b),表明全身免疫不足以提供针对中枢神经系统感染的保护。值得注意的是,IVT免疫也可以保护小鼠,但所有AC免疫小鼠都死亡 (图1b),这表明IVT免疫在大脑中驱动保护性免疫反应。 作者推断眼脑轴的免疫反应与其他器官的情况一样,必须由局部淋巴结(LN)介导。为了研究IVT免疫后促进大脑保护的细胞机制,作者首先通过手术结扎颈深部淋巴结(dCLN)的淋巴管,这是引发大脑免疫反应的关键。这完全消除了IVT免疫提供的保护,表明局部中枢神经系统LN回路将抗原排入dCLN的重要性(图1c)。同时,补充数据通过免疫记忆相关实验,证明IVT免疫在dCLN中产生局部抗原特异性CD4 T和B细胞应答是宿主抗病毒中枢神经系统保护所必需的。 为了进一步解决IVT免疫介导的保护是否在大脑局部发展,作者设置了具有不同免疫状态的异种小鼠对(图1d)。当IVT免疫小鼠与未免疫小鼠配对时,只有最初免疫的小鼠(左)而不是它们的异种伴侣(右)能够抵抗ic的病毒攻击(图1e)。此外,通过检测不同免疫途径抗HSV抗体的定位,作者发现,尽管所有免疫途径都导致血清中存在抗HSV -2抗体,但只有通过ic和IVT免疫的小鼠脑脊液中可检测到抗HSV -2抗体(图1f)。这些数据表明,IVT免疫通过局部抗体依赖反应独特地介导中枢神经系统保护。 最后,为了确定这种眼脑轴介导的中枢神经系统保护是否不止局限于HSV-2,作者研究了类似疫苗接种策略对单纯疱疹病毒-1(HSV-1)和肺炎链球菌的疗效。用热灭活的HSV-1或肺炎链球菌通过ip、ic、AC或IVT途径免疫小鼠,30天后再用致死剂量的相同病原体进行免疫。与HSV-2模型的结果相似,IVT和ic免疫小鼠的数据显示它们几乎具有完全的保护作用。相比之下,所有未接种、ip免疫和AC免疫的小鼠都死亡 (图1g-h)。这些数据表明,眼脑轴免疫与许多中枢神经系统疾病具有特殊的相关性和广泛的适用性。
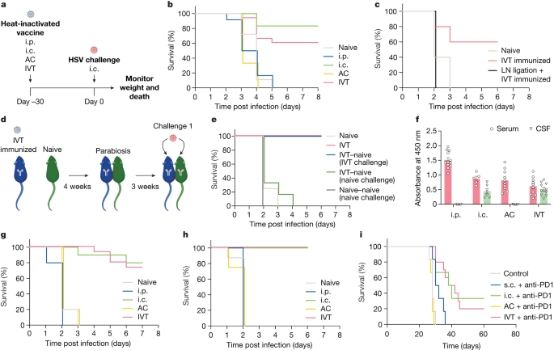
图1. 后眼中的抗原在大脑中引起免疫反应
2、眼睛有一个分隔的引流系统 作者的免疫研究揭示了AC和眼玻璃体之间的不同免疫反应。一般认为,房水通过包括施莱姆管和小梁网在内的常规流出通道从房水室流出,眼后腔室(尤其是玻璃体)的引流尚不清楚。 为了研究眼球前后不同的引流系统,作者通过AC或IVT途径注射荧光标记的葡聚糖,并量化葡聚糖保留的动力学(图2a)。IVT给药后葡聚糖清除率(K=1.369)明显低于AC给药后(K=4.267;图2b)。这一观察结果可以用两种可能性来解释:要么隔室有独特的引流路径,要么每个隔室的引流限速步骤不同(即通过玻璃体的扩散可能是最慢的步骤)。作者认为这些可能的解释可以通过观察染料在体内的定位来解析。与IVT注射后相比,AC注射后血液中检测到的染料浓度明显更高。注入AC的染料定位于同侧sCLN,而IVT注入的染料除了定位于同侧sCLN外,还定位于双侧dCLN(图2c-e)。AC注射后结扎sCLN,而非dCLN,可显著增加眼内染料潴留(图2f)。对于IVT注射,单独结扎sCLN或dCLN都会导致眼睛中染料潴留增加(图2g)。这些结果证明了眼内AC和玻璃体间有一个分隔的引流系统,而从玻璃体到dCLN有一条特定的途径。
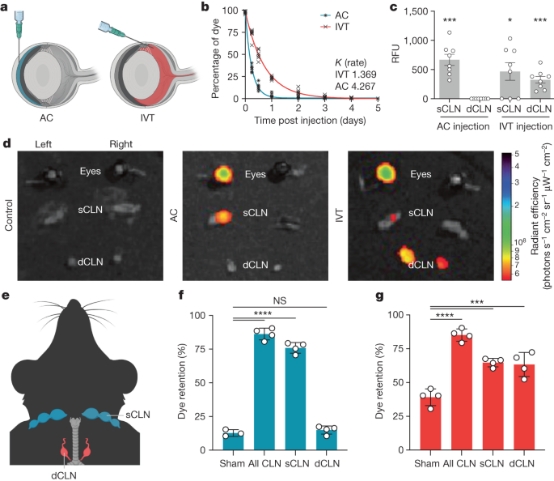
图2. 眼睛有一个分室的淋巴引流系统
3、视神经鞘包含功能性淋巴管 大分子于LN的定位不同表明,淋巴血管网络可能介导这些隔室的引流。虽然最近的一项研究描述了小鼠眼淋巴系统的存在,且类似于大脑的淋巴系统,但介导玻璃体引流的淋巴管功能网络尚未得到解决。因此,作者使用转录组学方法以及iDISCO (一种组织透明成像技术)来获得与不同脊椎动物视神经相关的淋巴血管网络的全局图。 除了在小梁网和视网膜中含有表达淋巴样基因特征的巨噬细胞外,作者还发现视神经鞘中也含有淋巴样基因特征。与此同时,iDISCO展示了覆盖斑马鱼、小鼠、兔、猪、非人灵长类动物和人类视神经的淋巴管,证明了淋巴系统的进化保守特征(图3a-b)。在所有哺乳动物中,作者都发现了 LYVE1 和血管内皮生长因子受体3 (VEGFR3)共定位染色的血管结构。 值得注意的是,淋巴脉管系统是在神经周围的膜上,而不是神经本身。 为了提高染色的敏感性,作者从视神经中解剖了视神经鞘。作者在摘除前进行了灌注固定,保留了沿神经的淋巴网络的解剖结构,避免视神经鞘在摘除后会缩回。作者利用具有良好特征的耳淋巴系统作为对照组,使用额外的标记(VEGFR3,PROX1,LYVE1,CD31和podoplanin)验证了视神经鞘淋巴管的存在。为了使用遗传方法进一步表征这些脉管系统,作者使用了两种不同的报告小鼠,能够对淋巴管进行高度特异性染色。这些并行方法共同证实了视神经鞘中确实存在淋巴管。 然后作者尝试评估这些淋巴管的功能。在IVT注射荧光示踪剂后(但不是AC注射),示踪剂在沿着视神经的 VEGFR3+ 脉管系统中可见。注射的LYVE1抗体可以有效地标记视神经鞘淋巴管,这表明像蛋白质这样的大分子可以从玻璃体中自由渗透到这些淋巴管中。作者的主要假设是是基于对大脑的硬膜淋巴管的理解,认为来自眼睛的分子通过脑脊液进入视神经鞘淋巴管,类似于分子从大脑移动到硬脑膜淋巴管的方式。为了测试这一点,作者检查了IVT注射后染料和抗体的分布。在静脉注射后,作者检测到CSF的微量染料,而脑内注射后,作者发现脑脊液含有微量的染料。此外,IVT路线注射的抗体不能充分标记硬脑膜淋巴管。这些数据表明,静脉注射染料可能进入了视神经上的局部脑脊液空间,并没有通过脑硬膜脑膜排至 dCLN。为了分析大分子如何进入视神经鞘周围的淋巴管,作者探究了注入玻璃体的分子是如何离开眼睛的。在IVT AF647-OVA注射后,作者观察到存在流向视神经乳头的定向流。 眼睛切片的高分辨率检查显示,示踪剂主要集中在视神经头,有一些扩散通过视网膜。通过视网膜的扩散显示了一种类似于先前描述的视网膜淋巴细胞模式——一种横跨视网膜的细胞旁垂直条纹。 为了验证这些淋巴管引流玻璃体的能力,作者通过三种不同的方式递送血管内皮生长因子 C (VEGFC,一种淋巴刺激器): AC、IVT、小脑池内(ICM;针对视神经)。首先,作者通过荧光示踪剂证实了ICM注入的示踪剂只能到达视神经,而不能到达眼睛(图3d-e)。VEGFC 递送两天后,通过 IVT 途径注射荧光右旋糖酐,并在12小时后分析保留情况。通过AC递送VEGFC并没有改变玻璃体中葡聚糖的引流情况,表明前淋巴刺激不足以驱动玻璃体引流。相比之下,VEGFC 的 IVT 和 ICM 给药增加了玻璃体中葡聚糖的引流,而后者是以剂量依赖性方式(图3g),支持了眼睛后室通过视神经上的淋巴脉管系统引流至 dCLN 的观察结果。为了进一步证实 VEGFC 在调节视神经鞘淋巴管中的作用,作者还通过 IVT 途径分别递送重组腺相关病毒rAAV-VEGFC 和可溶性血管内皮生长因子受体3 (sVEGFR3),发现 VEGFC和sVEGFR3在视神经鞘淋巴管系统中的表达显着增加或降低。总之,这些数据表明视神经鞘上存在功能性淋巴管网络,该网络将后眼连接到一组独立于眼睛其他部分但与中枢神经系统其他部分共享的淋巴结。
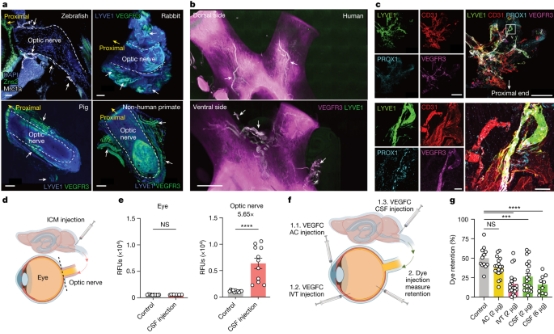
图3. 视神经鞘淋巴管引流后眼
4、通过眼部淋巴管增强基因治疗 在确认了后眼引流的免疫学重要性后,作者接下来研究了利用这一发现的潜在治疗应用。rAAV(腺病毒载体)是最常见的体内基因递送载体,因为它们具有安全有效的转导作用,然而对rAAV的获得性免疫限制了其重复给药的功效。作者首先使用ELISpot测定法表征了AC和IVT施用rAAV后LN和视网膜中rAAV特异性CD8 T细胞诱导。尽管AC和IVT注射在 sCLN中诱导了相似数量的rAAV特异性CD8 T细胞,但IVT注射特异性地在dCLN和视网膜中诱导了更多rAAV特异性CD8 T细胞,这在AC注射后未观察到(图4a-b)。作者推断,视神经淋巴引流有助于对rAAV的免疫反应,特别是对于基于视网膜的治疗方法,从而限制了其效用。为了测试这一点,作者首先给予了第一剂的 rAAV,1 个月后,给予了第二剂表达 RFP 的 rAAV (rAAV-RFP)。同时,在第二次给药时给予幼稚小鼠rAAV-RFP作为基线对照(图4c)。继发感染后的RFP表达水平明显低于初次感染后的RFP表达水平(图4d-e)。sCLN或dCLN结扎后进行的实验证实了眼淋巴血管的重要性,表明只有dCLN结扎才能减轻对rAAV的免疫反应并恢复继发性rAAV-RFP转导效率。由于手术结扎淋巴结不是治疗上可行的选择,作者使用了另一种方法来抑制淋巴管的分子活性:IVT给药sVEGFR3,作者发现其抑制淋巴引流的程度与手术结扎相似。作者发现,VEGFC的存在进一步加剧了对rAAV的免疫反应,而使用sVEGFR3抑制VEGFC信号可以使第二次给药与原发性感染一样有效(图4f-g)。这些实验确立了后眼淋巴管在调节基于rAAV的基因疗法疗效中的作用,并提出了一个平台来克服当前限制重复基因治疗的障碍。
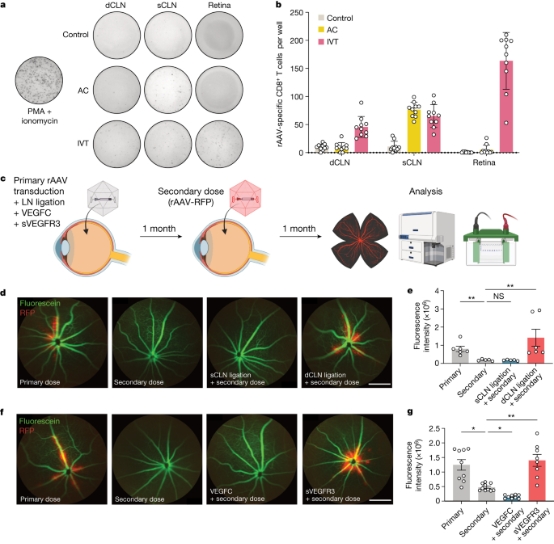
图4. 淋巴抑制使rAAV重复给药成为可能
5、讨论与总结 作者证明,眼睛的后室有一个独特的淋巴引流系统,在解剖学上与dCLN的CNS脑膜淋巴网络接合。先前的研究描述了人类和非人类灵长类动物视神经上存在稀疏的淋巴毛细血管。作者利用空间转录组学、几种成像技术、体内遗传操作和示踪剂注射,绘制了视神经鞘中较大的淋巴管系统网络,并描述了其将玻璃体引流到dCLN的功能。 以前,没有传统淋巴管的眼睛和大脑都被认为是免疫特权组织,因为外来组织移植物可以在植入后存活。此外,据报道,递送至眼睛前房和后房的抗原可诱导外周免疫耐受。然而,作者的研究表明,通过 IVT 疫苗接种传递到后眼的致病抗原可以引流到 dCLN 并在大脑中启动局部保护性免疫反应,该反应依赖于 CD4 T 细胞、B 细胞和 CNS 隔室中的局部抗体。尽管在作者的研究中使用不同的疾病模型和治疗干预措施表明了作者研究结果的普遍性,但不同的病原体或疾病可能偏向于适应性免疫反应的特定分支。值得注意的是,在作者和其他人的实验中,并不是说sCLN缺乏来自中枢神经系统的抗原;相反,引流到sCLN中不足以在CNS中产生免疫反应,未来的研究揭示了这两种LN之间的根本区别,可能会让作者更好地了解这里描述的观察结果。一种可能性是,sCLN和dCLN在产生有效的脑归巢T细胞或脑驻留T细胞的能力上可能有所不同,据报道,这些T细胞可以防止大脑中的病原体再感染。除了局部抗体在IVT疫苗接种中的保护作用外,研究脑驻留T细胞是否在攻击过程中发挥作用也很重要。 此外,引导这些免疫反应到大脑的机制仍需进一步研究。目前的研究结果表明,后眼和大脑对外来抗原的免疫耐受是由被动和主动的免疫抑制驱动的,而不是由于缺乏免疫反应。因此,眼睛的后引流系统可能在调节涉及中枢神经系统的各种疾病的免疫激活和抑制中起关键作用。目前治疗或诊断中枢神经系统疾病的常规方法要么是侵入性的,要么无法启动局部免疫。在怀疑中枢神经系统因感染或恶性肿瘤而出现占位效应增加的情况下,通过腰椎穿刺等方法进入脑脊液通常很危险。虽然远非临床适用性,但作者的研究提出玻璃体是一种相对非侵入性且更容易获得的途径来引发中枢神经系统免疫。 如何利用后路引流通路的机制来治疗眼部疾病也值得进一步研究。具体来说,眼后淋巴引流系统的识别提供了一种潜在的有效引流途径,以分别调节眼内压或清除青光眼或黄斑水肿等疾病状态下的不需要的液体。此外,最近描述的眼睛中存在淋巴系统,需要更多的工作来阐明这些通路如何相互作用以在眼睛中提供稳态。总之,本研究的结果表明,后眼和大脑之间的连接不仅是一个神经元连接,而且是一个共享的免疫回路,协调从外周到中枢神经系统的免疫力。 撰稿人:周华源 审稿人:刘学良
|