上海交通大学医学院分子医学研究院杨宇研究员团队主要从事核酸分子医学、核酸生物材料、免疫微环境调控等交叉学科领域研究。在谭蔚泓院士的指导下,以临床需求为导向,利用生物材料、细胞表面核酸分子工程发展新型免疫和靶向治疗策略,用于肿瘤、炎症(心肌梗死、急性肺损伤、骨质疏松等)、神经退行性疾病(阿尔茨海默病、帕金森病等)的治疗。以下是该团队近期在细胞表面DNA分子工程和核酸适体自组装体的部分研究成果: 1. 金属-DNA自组装体调节骨质疏松微环境治疗骨质疏松|Science Advances
骨质疏松症是一种慢性骨骼疾病,其特征是骨含量低和骨组织微观结构恶化,随之增加骨脆性和骨折的风险。在这种疾病的发展过程中,骨质疏松微环境中各种骨细胞、无机成分和免疫细胞之间功能紊乱的相互作用通常共同作用于形成最终的骨质疏松。目前对骨质疏松症的临床治疗主要针对破骨细胞的生物学特性,忽视了其它骨细胞、免疫细胞、细胞因子和无机成分在形成异常骨质疏松微环境中的协同作用。
杨宇研究员团队联合仁济医院骨科李展春、肖洁团队等开发了由Ca2+和超长功能性单链DNA序列组成的金属-多聚DNA自组装纳米粒(Ca-polyCpG MDNs),用于重构骨质疏松微环境治疗骨质疏松症。通过滚环扩增得到的Ca-polyCpG MDNs能够中和破骨细胞分泌的氢离子对骨骼的侵蚀,同时提供钙补充,促进骨损伤的重矿化和修复。此外,Ca-polyCpG MDNs中的免疫佐剂polyCpG能够诱导破骨细胞生成抑制因子IL-12的高分泌,降低破骨细胞功能效应蛋白的表达,从而抑制破骨细胞分化,进一步减少破骨细胞介导的骨吸收。有趣的是,在滚环扩增合成长单链DNA反应中生成的副产物PPi4-可作为双膦酸盐类似物,增强Ca-polyCpG MDNs对骨骼的靶向性(图1)。在卵巢切除小鼠和兔骨质疏松(OVX)模型中,Ca-polyCpG MDNs通过恢复骨质疏松微环境,抑制骨吸收并促进骨修复,为骨质疏松症治疗提供了新思路。
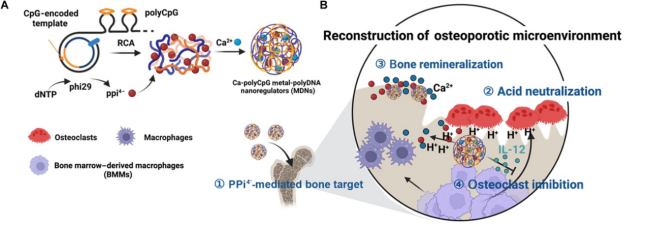
图1:金属-多聚DNA自组装纳米粒的制备及其重构骨质疏松微环境机理。 Xueliang Liu, F Li, Z Dong et al. Metal-polyDNA nanoparticles reconstruct osteoporotic microenvironment for enhanced osteoporosis treatment. Science Advances 2023. Highlighted by Nature Reviews Rheumatology 2023. (IF=13.6) DOI: 10.1126/sciadv.adf3329 https://www.science.org/doi/10.1126/sciadv.adf3329
2. 心靶向纳米酶阻断炎症-自由基恶性循环治疗心梗|Advanced Materials
心梗发生后的炎症-自由基循环和心脏特定部位的高血流量是治疗心梗疾病关注的焦点。然而,现有的抗炎药物在心脏部位的低聚集效率和未能有效阻断炎症-自由基循环成为心梗治疗效果不佳的关键因素。分子医学研究院杨宇团队联合仁济医院放射科吴连明等合成了一种新型药物基金属纳米酶(Fe-Cur@TA NPs),能够有效靶向并滞留在心脏部位,显著提高了心肌细胞中的摄取效率(图2)。这种纳米酶不仅具有高效的活性氧清除能力,还显著增强了姜黄素(Cur)药物的抗炎能力。它减少了急性免疫细胞对梗死病灶的渗入,促进了巨噬细胞极化成M2样表型,抑制了炎性细胞因子的分泌,从而能够高效阻断炎症-自由基的恶性循环。在小鼠和临床相关的比格犬心肌梗死模型中,Fe-Cur@TA表现出显著的心脏保护作用,改善了心脏功能,并减轻了不良的重塑效应。
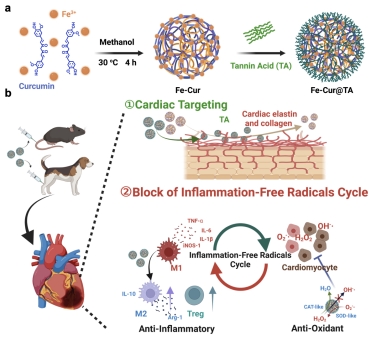
图2: Fe-Cur@TA制备过程和心脏靶向阻断过度炎症自由基恶性循环治疗心肌梗死的应用。
Xueliang Liu, B Chen, J Chen et al. A Cardiac-Targeted Nanozyme Interrupts the Inflammation-Free Radical Cycle in Myocardial Infarction. Advanced Materials 2023. (IF=29.4) DOI: 10.1002/adma.202308477 https://onlinelibrary.wiley.com/doi/10.1002/adma.202308477
3. 基于DNA适配体的共价LYTAC技术用于免疫检查点降解疗法|JACS
免疫检查点阻断(ICB)治疗虽然取得了巨大的临床成功,但在临床癌症治疗中,客观反应率仍然较低。作为一项概念验证研究,我们提出了一种新的免疫检查点降解(ICD)治疗方法,它依赖于溶酶体靶向嵌合体(LYTAC)来耗尽肿瘤细胞表面的免疫检查点程序性死亡配体-1(PD-L1)。分子医学研究院杨宇团队、韩达团队联合苏州大学刘庄团队设计了嵌合适配体一侧以溶酶体转运受体为靶点,另一方面允许双正交共价偶联增强特异性结合(图3)。这种共价LYTAC能够劫持PD-L1进行溶酶体降解,在复杂的体内环境中大大提高非共价LYTAC的效率。除了消除PD-1/PD-L1轴相关的免疫抗性外,本研究首次证明了LYTAC触发的PD-L1降解可以直接导致肿瘤细胞的免疫原性凋亡,从而诱导肿瘤特异性免疫应答,与ICB抗体治疗相比具有巨大优势。此外,与基于抗体的ICB治疗相比,共价LYTAC的ICD治疗获得相当或更高的抗肿瘤疗效,同时显著减少炎症损伤。共价LYTAC可以作为特异性降解其他膜相关蛋白的通用平台,使其成为一个很有前途的应用工具。本研究为复杂环境中有效的LYTAC提供一种新的分子工具,为推动基于DNA的LYTAC药物在体内和临床应用提供有价值的见解。
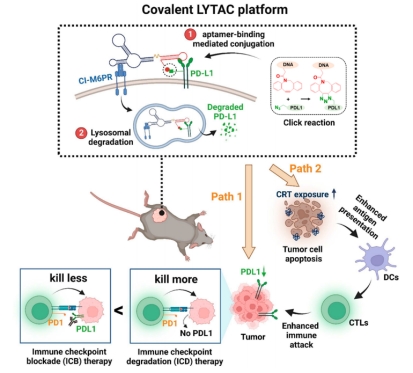
图3:免疫检查点降解(ICD)治疗的共价LYTAC平台 Yuqing Li, X Liu et al. Covalent LYTAC Enabled by DNA Aptamers for Immune Checkpoint Degradation Therapy. Journal of the American Chemical Society 2023. (IF=15.0) DOI: 10.1021/jacs.3c03899 https://pubs.acs.org/doi/10.1021/jacs.3c03899
4. 金属-DNA自组装体通过抑制自噬增强化学动力疗法|Angewandte Chemie
化学动力学疗法(Chemodynamic Therapy,CDT),是一类基于肿瘤细胞自身内源性化学产物转化反应的新型肿瘤特异性治疗技术,为临床肿瘤治疗提供了新的研究范式。然而,自噬(autophagy)作为关键的癌细胞自我保护机制严重削弱了CDT的肿瘤治疗效果。对此,分子医学研究院杨宇团队联合同济大学杨洋团队开发了一种新型金属-DNA自组装体(DACs-Mn),通过DNA酶特异性识别和切割肿瘤细胞自噬RNA片段,实现了对肿瘤自噬保护的抑制,从而增强CDT的肿瘤治疗效果(图4)。DACs-Mn是由Mn离子和滚环扩增反应合成的功能性长单链DNA自组装而成。长单链DNA包含有精心设计的多聚AS1411核酸适体和DNA酶功能序列。其中AS1411核酸适体可特异性结合高表达核仁素的肿瘤细胞,增强了肿瘤的摄取。内吞的纳米自组装体在酸性条件下可释放出Mn2+离子,利用H2O2生成羟基自由基(?OH)进行化学动力治疗。一同释放的长单链DNA结构中的DNA酶序列则在Mn2+离子存在的情况下特异性地切割自噬基因ATG5 mRNA,降低了肿瘤细胞自噬水平,从而阻断了自噬对CDT氧化应激的抑制,最终实现了自噬抑制增强的CDT肿瘤治疗效果。有意思的是,利用DACs-Mn增效的CDT能够诱导肿瘤细胞产生免疫原性死亡,从而释放出肿瘤抗原以激活免疫系统。DACs-Mn和免疫检查点阻断的联合治疗不仅抑制了原发性肿瘤的生长,还对远端转移性肿瘤产生了良好的抑制效果。
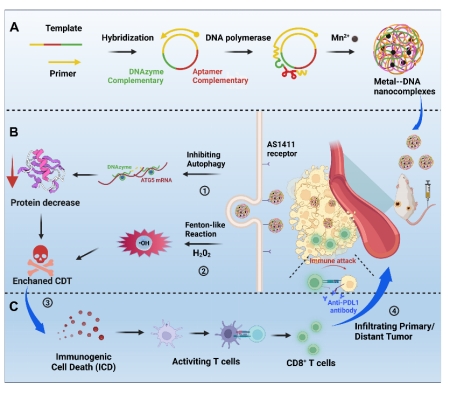
图4:DACs-Mn抑制肿瘤自噬保护,增强CDT的肿瘤治疗效果 Chao Gu, X Liu et al. Metal‐DNA Nanocomplexes Enhance Chemo‐dynamic Therapy by Inhibiting Autophagy‐Mediated Resistance. Angewandte Chemie International Edition 2023. (IF=16.6) DOI: 10.1002/anie.202307020 https://onlinelibrary.wiley.com/doi/10.1002/anie.202307020
5. 基于智能DNA纳米反应器的在体肿瘤简易成像与精准治疗|Angewandte Chemie 肿瘤影像学对于肿瘤定位、手术指导和预后监测至关重要。尽管纳米技术的进步促进了光热成像、光声成像、核磁共振成像和多模态成像等各种肿瘤影像技术的发展,但它们仍然受到特异性和成本效益的限制。i)不智能的“始终开启”或单参数响应信号输出以及显著的脱靶效应导致难以区分肿瘤组织信号与正常组织背景;ii) 现有的诊断策略,如磁共振成像、正电子发射断层扫描等价格昂贵。因此,如何发展一种特异性强,且具有成本效益的理想肿瘤影像策略,实现智能且易于读取的在体肿瘤成像是一个重要的研究方向。为了解决这些问题,上海交通大学分子医学研究院杨宇教授与同济大学附属第十人民医院朱小立研究员团队通过充分利用肿瘤与正常组织的微环境差异,开发了一种用于肿瘤在体简易成像与精准治疗的智能DNA纳米反应器(iDNR)。 iDNR是一种被合理设计的多功能DNA多聚物,兼具结合肿瘤标志物核仁素的核酸适体功能,响应肿瘤微环境过氧化氢(H2O2)的酶促催化活性,两种功能共同构成了多个参数响应的“AND”逻辑门,能够智能催化光热物质聚多巴胺(PDA)在肿瘤部位的选择性沉积。基于这一设计,iDNR成功实现了基于温度计的肿瘤在体简易成像,并展示了与流式细胞术和光声成像相媲美的性能。此外,iDNR对肿瘤组织的高度选择性还被成功用于实现精准的肿瘤光热治疗(PTT),通过智能加热肿瘤组织来杀灭肿瘤。iDNR介导PTT激活免疫结合免疫检查点阻断(ICB)治疗,能够进一步抑制远端肿瘤的生长。
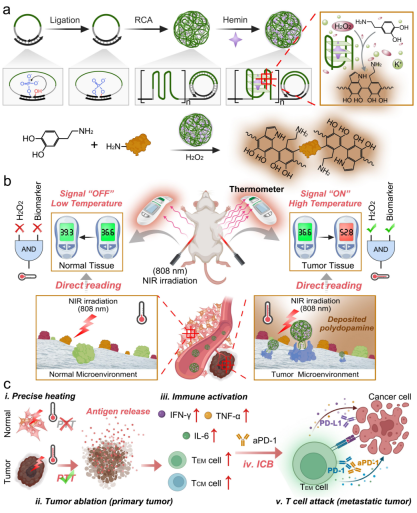
D. Mao et al. Intelligent DNA nanoreactor for in vivo easy-to-read tumor imaging and precise therapy, Angew Chem Int Ed Engl, (2023) e202311309. (IF=16.6) DOI: 10.1002/anie.202311309 https://onlinelibrary.wiley.com/doi/10.1002/anie.202311309
6. 基于核酸适体的纳米胶束实现药物靶向递送|Journal of Nanobiotechnology(IF: 10.2) 基于核酸适体的纳米胶束已成为一种很有前途的医疗和纳米技术应用系统。然而,两亲适体胶束在生理环境中与细胞膜相互作用时的固有不稳定性可能会损害其对癌症细胞的特异性靶向功能。分子医学研究院谭蔚泓院士团队、杨宇团队等提出了一种超稳定的胶束纳米递送系统,一种由核酸适体和多价疏水性聚(马来酸酐-alt-1-十八碳烯)(C18PMH)组成的两亲性共聚物自组装胶束(图5)。使用Ce6作为药物模型,我们的C18适体胶束表现出有效的肿瘤靶向和结合,促进Ce6进入靶向细胞进行光动力治疗。此外,我们的C18适体胶束可以负载其他疏水性药物,并显示出良好的治疗效果。这些C18-受体胶束可以作为装载多种药物的通用平台,为治疗癌症提供更安全、更有效的解决方案。
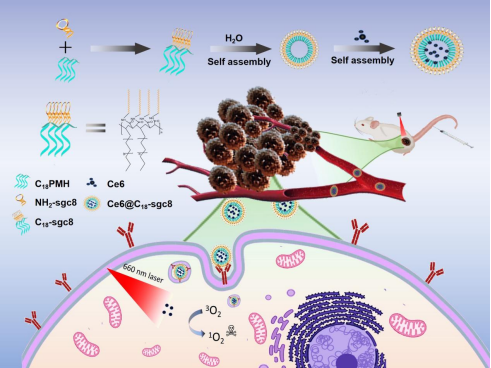
图5:C18-sgc8的合成方法及其在靶向光动力治疗中的应用。 Ganghui Chen et al. Aptamer-based self-assembled nanomicelle enables efficient and targeted drug delivery. Journal of Nanobiotechnology 2023. (IF=10.2) DOI: 10.1186/s12951-023-02164-y https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-023-02164-y
以上研究工作得到国家重点研发计划、国家自然科学基金、上海市核酸化学与纳米医学重点实验室和上海地方高水平大学创新研究团队的资助。
|