课题组工作|JACS|酶簇球形核酸通过缓解肿瘤乏氧增强铜死亡和抗肿瘤免疫反应 铜死亡,作为一种依赖铜离子的调节性细胞死亡机制,已被发现能够进一步激发免疫反应并促进免疫抵抗力的形成。然而,其治疗潜力受到几个因素的限制:首先,由于细胞内铜离子浓度相对较低,破坏铜的稳态环境具有一定的挑战性;其次,铜死亡主要影响线粒体内的三羧酸循环(TCA循环),而在缺氧条件下,肿瘤细胞倾向于依赖糖酵解作为其主要的能量来源,这一现象显著抑制了铜死亡的效果;最后,肿瘤微环境中的缺氧条件通过促进免疫抑制来发挥作用,例如,低氧诱导因子-1(HIF-1)的表达在缺氧反应中增加,这不仅影响促炎免疫细胞的活性,还会诱导免疫细胞转向免疫抑制表型,并降低效应T细胞的活性。此外,铜死亡还能上调肿瘤细胞表面的程序性死亡配体1(PD-L1),为PDL1治疗提供补充,从而产生显著的协同效果。因此,考虑到铜死亡与免疫治疗之间在缺氧抑制背景下观察到的共性,通过减轻肿瘤的缺氧状况来增强铜死亡诱导的免疫治疗显得尤为重要。 基于这一理念,近日,谭蔚泓院士、杨宇研究员团队在《Journal of the American Chemical Society》杂志在线发表了题为“Enzyme core spherical nucleic acid that enables enhanced cuprop-tosis and anti-tumor immune re-sponse through alleviating tumor hypoxia”的工作。研究人员开发了一项创新技术,将滚环扩增(RCA)技术整合到酶簇球形核酸(ecSNA)构建中。利用RCA诱导的DNA在酶表面的聚合,这种方法实现了在保持酶活性不受损害的同时,酶表面进行高密度核酸修饰,从而有效地促进了酶的固定化和功能化。CAT-ecSNA-Cu有效促进铜离子的运输,在细胞内积累铜离子,引发铜死亡。此外,该技术通过缓解肿瘤的缺氧状况和增强线粒体呼吸作用,进一步增敏铜死亡机制。肿瘤氧合状态的改善有效降低了HIF-1α蛋白的表达,改善了肿瘤的免疫抑制微环境,促使通过释放大量损伤相关分子模式(DAMPs)的铜死亡诱导的细胞死亡引发了免疫原性细胞死亡(ICD)。同时,长链多价CpG通过激活TLR-9作用发挥佐剂效果,促进树突状细胞(DC细胞)的成熟并增强其抗原呈递能力。除了诱导ICD外,铜诱导的细胞死亡还促进了肿瘤细胞中PD-L1蛋白的上调,与免疫检查点抑制剂αPD-L1联合使用时产生协同效果。这一策略进一步增强了铜诱导细胞死亡所引发的免疫反应,激活了长期的体内免疫记忆,有效抑制了肿瘤的转移和复发。综上所述,我们构建的基于CAT-ecSNA-Cu的纳米平台在多功能性和稳定性方面表现出色,通过缓解缺氧和与免疫检查点抑制剂的协同作用,在抑制原发性及远处肿瘤方面显示出巨大的潜力(示意图1)。
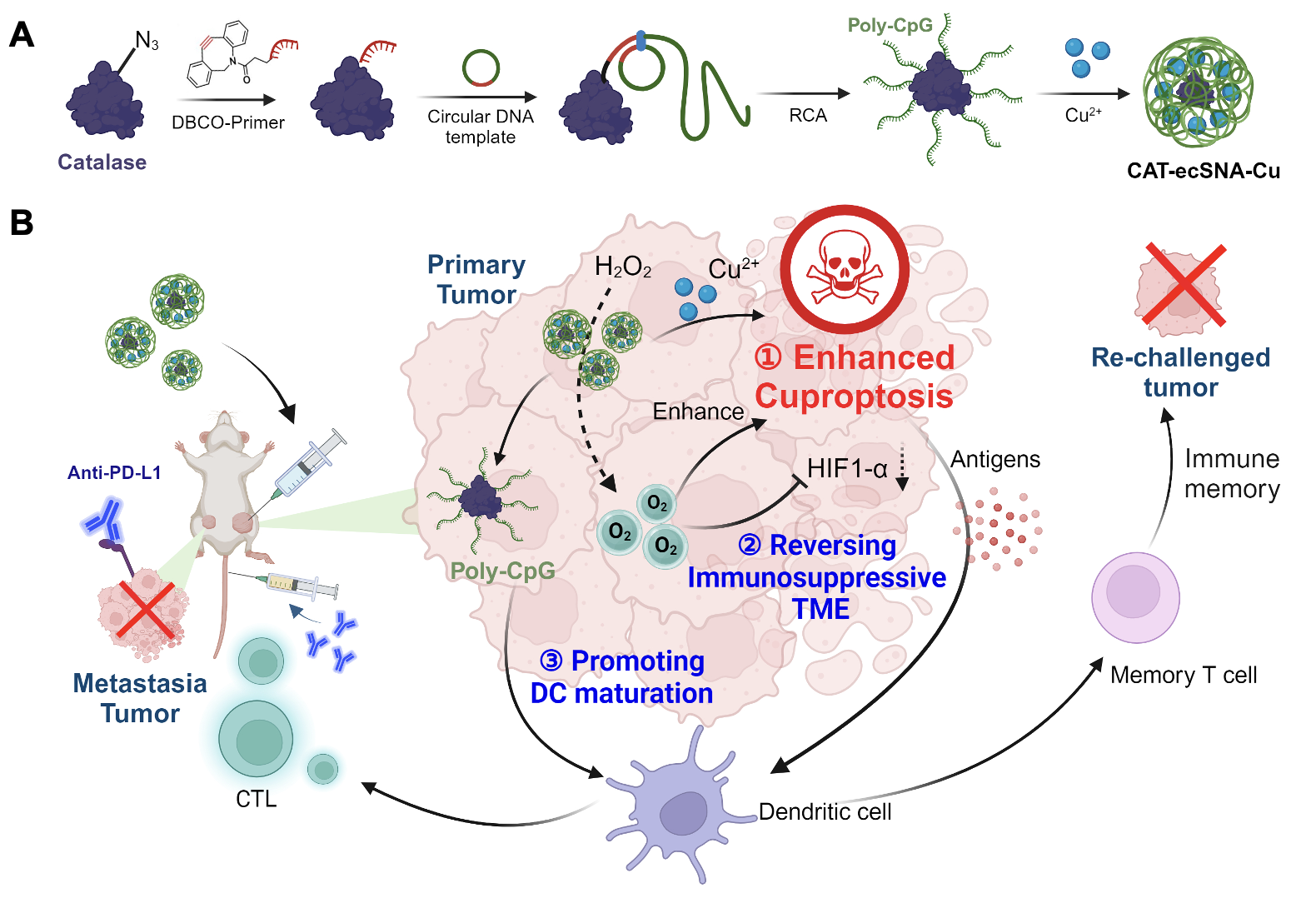
示意图1. (A)CAT-ecSNA-Cu的制备和(B)通过使用CAT-ecSNA-Cu缓解肿瘤乏氧增强铜死亡和触发强大免疫反应机制的示意图。 作者在CAT的表面进行DNA聚合反应,将长单链多价寡聚脱氧核苷酸(CpG)修饰在其表面,实现了对CAT的固定化和功能化。具体来说,DBCO标记的引物(DBCO-Primer)通过点击反应与NHS-PEG4-N3修饰的CAT偶联,制备了蛋白质-引物复合物(CAT-Primer)。随后,将可编码CpG序列的线性寡核苷酸通过T4 DNA连接酶形成环状模板,然后进行典型的RCA反应以制备酶簇球形核酸(CAT-ecSNA)。在CAT-ecSNA与CuCl2孵育后,成功制备了铜掺杂的酶簇球形核酸纳米平台(CAT-ecSNA-Cu)。凝胶电泳证实超长polyDNA的合成已经完成。通过AFM分析,证实核心CAT被密集的长链DNA包覆,得到的CAT-ecSNA-Cu纳米颗粒呈现出均匀的球形。使用包括凝胶电泳、DLS和蛋白酶K在内多种测试,作者证实CAT-ecSNA-Cu纳米颗粒中的核酸和酶具有优异的稳定性。此外,CAT-ecSNA-Cu纳米颗粒能够通过催化H2O2快速生成大量O2。这归因于CAT-ecSNA-Cu外部的长链核酸结构起到分子筛的作用,选择性地阻止大分子(如蛋白酶K)的非限制性通过,同时使小分子底物H2O2能够不受阻碍地扩散。基于上述分析,CAT- ecSNA-Cu可以大大增强CAT和CpG在血清和细胞内核酸酶环境中的稳定性,为其后续的生物学应用奠定基础(图1)。
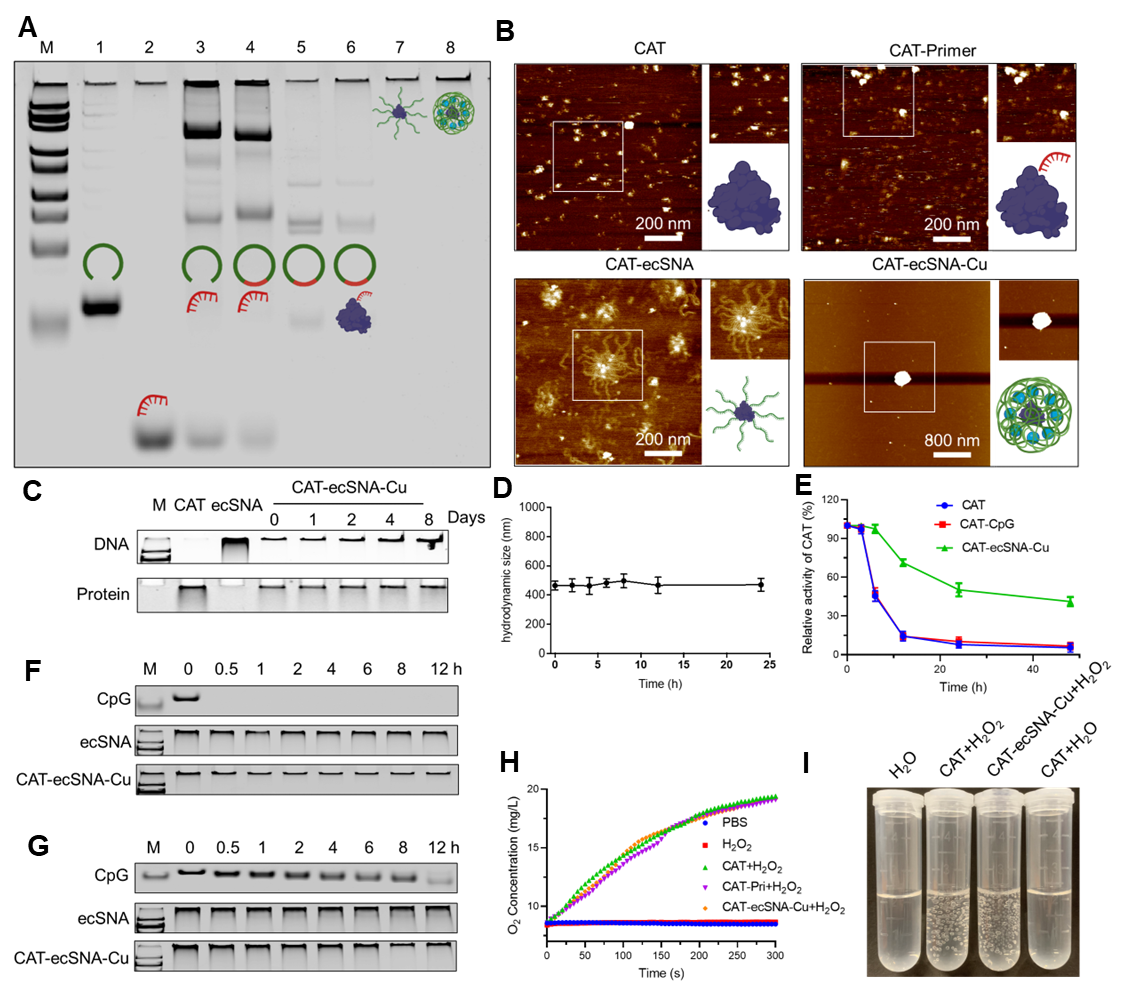
图1. CAT-ecSNA-Cu的制备和表征。 由于铜死亡是一种高度依赖线粒体呼吸的细胞死亡形式,缺氧的肿瘤微环境会显著抑制其作用。在本研究中,[Ru(dpp)3]Cl2被用作O2指示剂来测量细胞内O2含量,实验结果表明与ecSNA和ecSNA-Cu相比,CAT-ecSNA和CAT-ecSNA-Cu治疗后可以有效缓解肿瘤缺氧。与上述观察结果一致,细胞内的HIF-1α被CAT-ecSNA和CAT-ecSNA-Cu出色的缺氧缓解作用显著抑制。铜死亡是由细胞内铜的过度积累引起的,铜离子与硫酰化的线粒体酶结合诱导硫酰化二氢硫酰基转乙酰酶(DLAT)的寡聚化,导致蛋白毒性应激和最终的细胞死亡。免疫荧光染色和Western-blot蛋白印迹实验结果证实ecSNA-Cu和CAT-ecSNA-Cu引起细胞内DLAT的明显寡聚化,这归因于细胞内铜离子积累诱导的铜死亡。除了明显依赖于铜离子浓度外,氧含量的变化对铜死亡诱导的影响也有很好的联系。由于CAT有效地增加了肿瘤的氧合并抑制了HIF-1α的表达,DLAT的寡聚化进一步加强,证明基于增加氧合对铜死亡的致敏策略是可行和必要的。在用CCK-8法评估纳米颗粒的抗肿瘤活性实验中,作者发现,由于CAT的有效引入,CAT-ecSNA-Cu表现出比ecSNA-Cu更有效的肿瘤细胞抑制作用,这归因于肿瘤缺氧缓解促进了细胞线粒体呼吸,进而有效地促进了铜死亡的发生。随后,作者进一步探讨了铜死亡与免疫反应之间的关系。有趣的是,ecSNA-Cu和CAT-ecSNA-Cu诱导的铜死亡都可以显著触发肿瘤细胞表面钙网蛋白(CRT)的暴露,进一步诱导免疫原性细胞死亡,激活抗肿瘤免疫反应。此外,作为免疫佐剂的polyCpG的表面修饰能够有效激活TLR9受体,从而促进DC的成熟。通过流式细胞术证实与游离CpG相比,RCA形成的polyCpG表现出更强的稳定性,并促进了更有效的细胞摄取。同时,polyCpG的多价效应也能够产生更好的免疫佐剂效应(图2)。
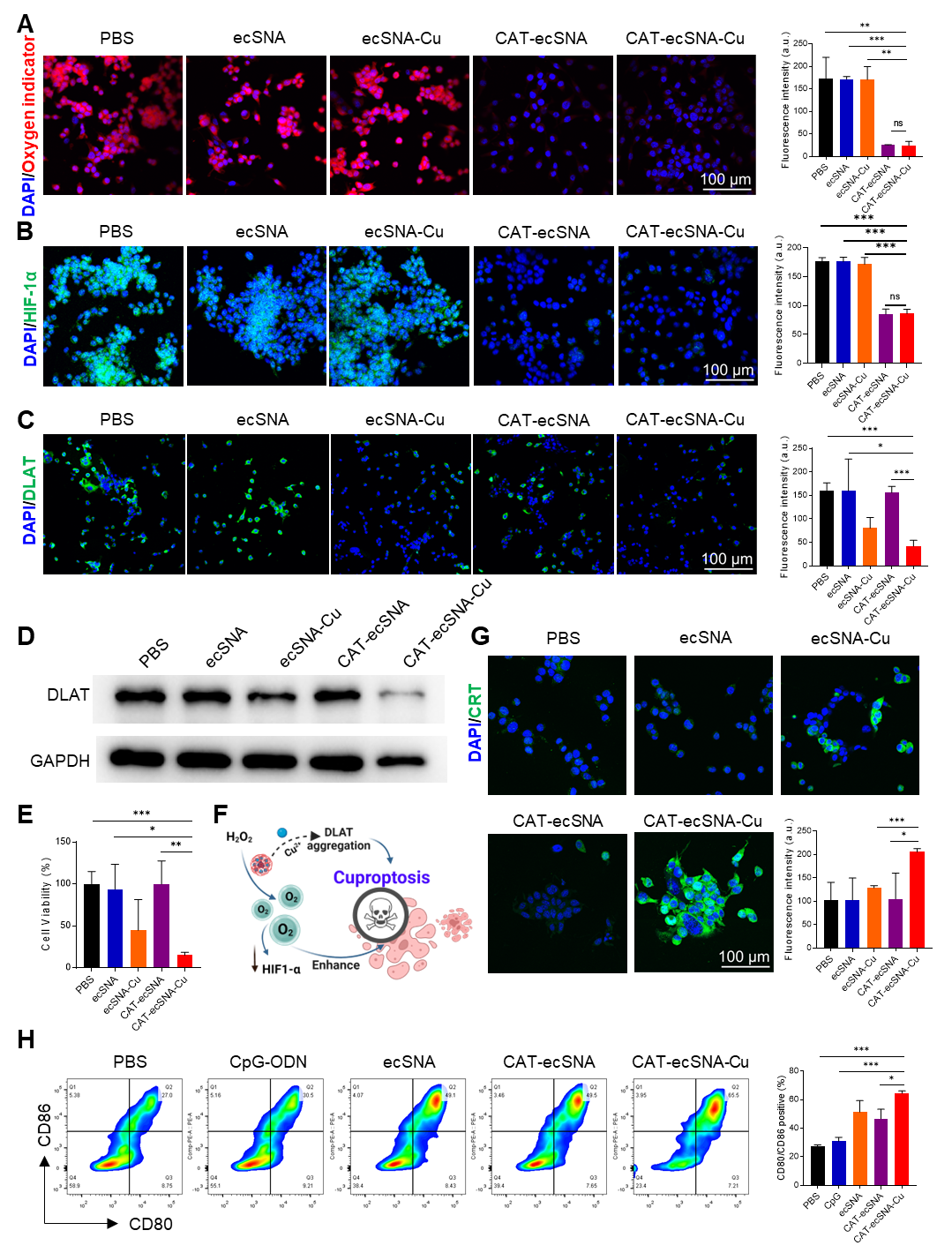
图2. CAT-ecSNA-Cu在体外增强铜死亡并刺激免疫反应
本文使用CT26肿瘤小鼠模型研究CAT-ecSN-Cu在体内的治疗效果。从皮下植瘤第7天开始,每2天瘤内注射给药CAT-ecSN-Cu,共3次。持续监测小鼠的肿瘤生长,作者证实CAT的引入显著提高了整个系统的治疗效果,CAT-ecSNA-Cu治疗组小鼠的生存期显著延长,其中四只小鼠获得了完全的肿瘤切除,没有晚期复发。肿瘤的免疫荧光图像显示,CAT的引入有效地改善了缺氧的肿瘤微环境,降低了HIF-1α的表达,CAT-ecSNA-Cu表现出显著的抗肿瘤作用。此外,在治疗期间,小鼠体重几乎没有显著变化,也没有观察到器官损伤(心、肝、脾、肺和肾),这证实了CAT-ecSNA-Cu具有良好的生物安全性和生物相容性(图3)。

图3. 在CT26荷瘤小鼠中评估CAT-ecSNA-Cu介导的铜死亡增强作用 本文进一步评价了铜死亡介导的体内抗肿瘤免疫的激活作用。免疫荧光染色证实了CRT在肿瘤组织中的暴露和分泌,表明铜死亡介导的ICD诱导了损伤相关分子模式(DAMP)的释放,并引发了有效的抗肿瘤免疫反应。此外,铜死亡的诱导导致肿瘤内PD-L1表达增加,从而增强对抗PD-L1治疗的潜在敏感性。因此,本文进一步探索了CAT-ecSNA-Cu与免疫检查点阻断剂(αPD-L1)联合使用的协同抗肿瘤作用,通过激活抗肿瘤免疫来抑制远处未治疗肿瘤的生长。首先,在小鼠右侧接种CT26细胞作为原发肿瘤。四天后,将CT26细胞进一步接种在小鼠左侧,以模拟肿瘤转移。在治疗阶段,αPDL1对原发性和远处肿瘤都表现出轻微的生长抑制作用。相反,CAT-ecSNA-Cu完全根除了原发性肿瘤,但对远处转移瘤的抑制作用很小。令人惊讶的是,CAT-ecSNA-Cu和αPD-L1的协同作用导致原发性肿瘤完全消融,同时显著抑制远处转移性肿瘤的生长。 为了全面评估各种制剂给药后的体内免疫反应,作者在给药5天后检测了小鼠腹股沟淋巴结、脾脏和远处肿瘤中的DC成熟和T细胞活化。结果显示与PBS组相比,CAT-ecSNA-Cu显著促进淋巴结和脾脏中DC的成熟,这归因于铜死亡诱导的ICD和polyCpG的促进作用。此外,CAT-ecSNA-Cu和αPD-L1的协同作用导致淋巴结和脾脏中成熟DC的比例最高。随后,作者还证实铜死亡诱导的PD-L1的高表达增加了αPD-L1的免疫阻断效率,T细胞的有效激活导致肿瘤细胞凋亡,进一步促进了DC的成熟。在协同治疗下,细胞因子如Ki67、Gzmb、IFN-γ和TNF-α的表达在远处肿瘤中也显著升高。总的来说,通过铜死亡诱导的免疫疗法和αPD-L1免疫检查点阻断的协同作用,实现了强大的体内抗肿瘤效果,这归因于先天免疫的成功激活,通过建立强大的全身免疫反应来抑制转移性肿瘤的生长(图4)。
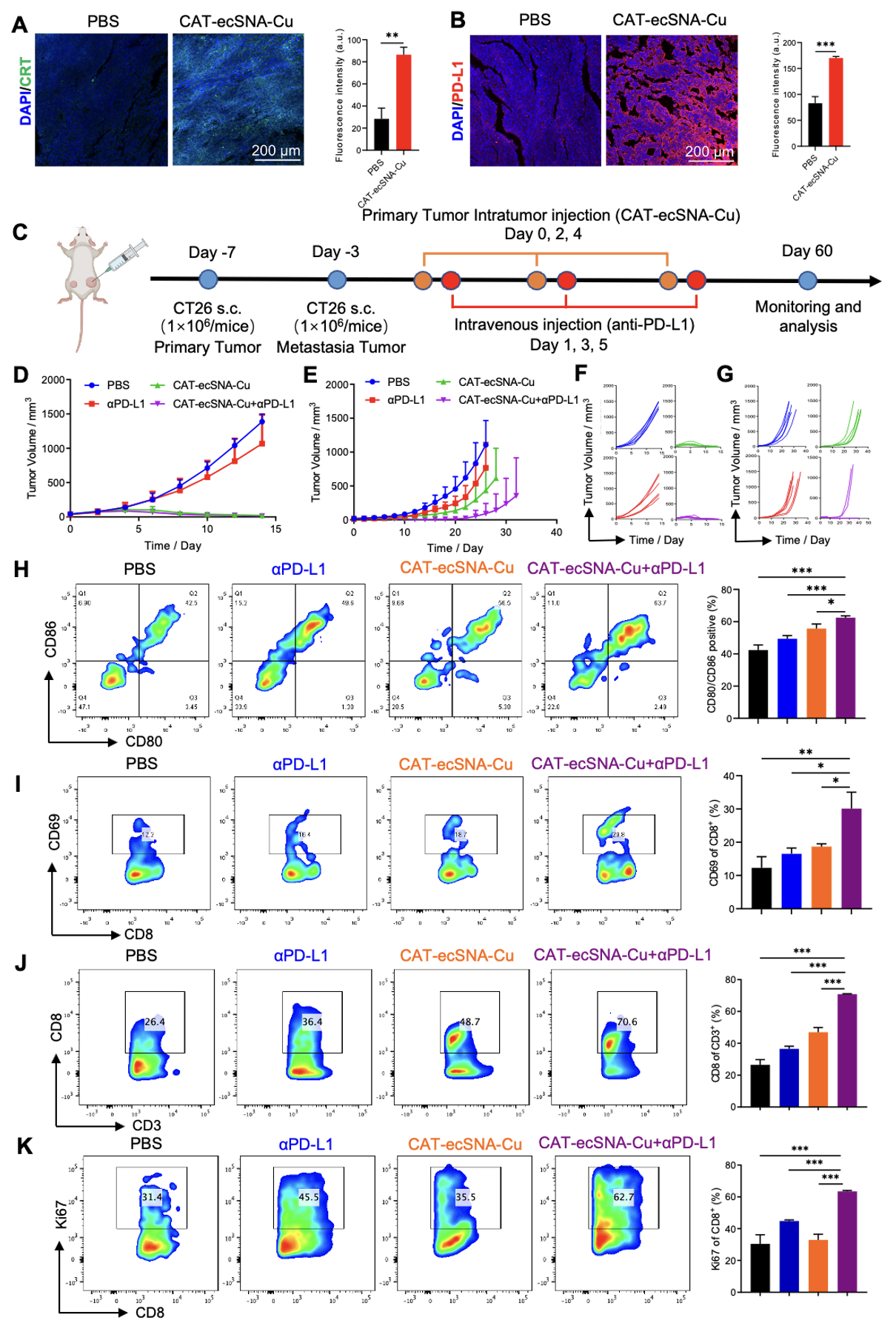
图4. CAT-ecSNA-Cu联合αPD-L1在CT26双侧肿瘤模型中抑制肿瘤转移的评价 基于上述验证,CAT-ecSNA-Cu通过诱导免疫原性细胞死亡获得了优异的免疫反应效果,这对原发性肿瘤的治疗至关重要。相反,免疫记忆是身体重新识别抗原并对其做出反应的能力,这对免疫疗法的长期效果至关重要。为了研究基于CAT-ecSNA-Cu的铜死亡诱导的免疫记忆,在原发性肿瘤第一次注射CAT-ecSNA-Cu后的第78天再次皮下植入肿瘤。与PBS组继发性肿瘤的爆炸性生长相反,CAT-ecSNA-Cu治疗组未检测到继发性肿瘤存活,这表明铜死亡能够激活生物体的长期免疫记忆,从而有效抑制肿瘤复发。随后,作者比较了二次植瘤前后小鼠血清中效应记忆T细胞(TEM)百分比的变化。研究发现,CAT-ecSNA-Cu处理小鼠的TEM百分比始终保持在较高水平(之前:35.1%,之后:34.6%),远高于PBS组(之前:11.3%,之后:23.4%)。这也证实了CAT-ecSNA-Cu通过触发铜死亡诱导的ICD可以实现极好的免疫治疗,并通过激活强大的免疫记忆效应抑制肿瘤复发(图5)。
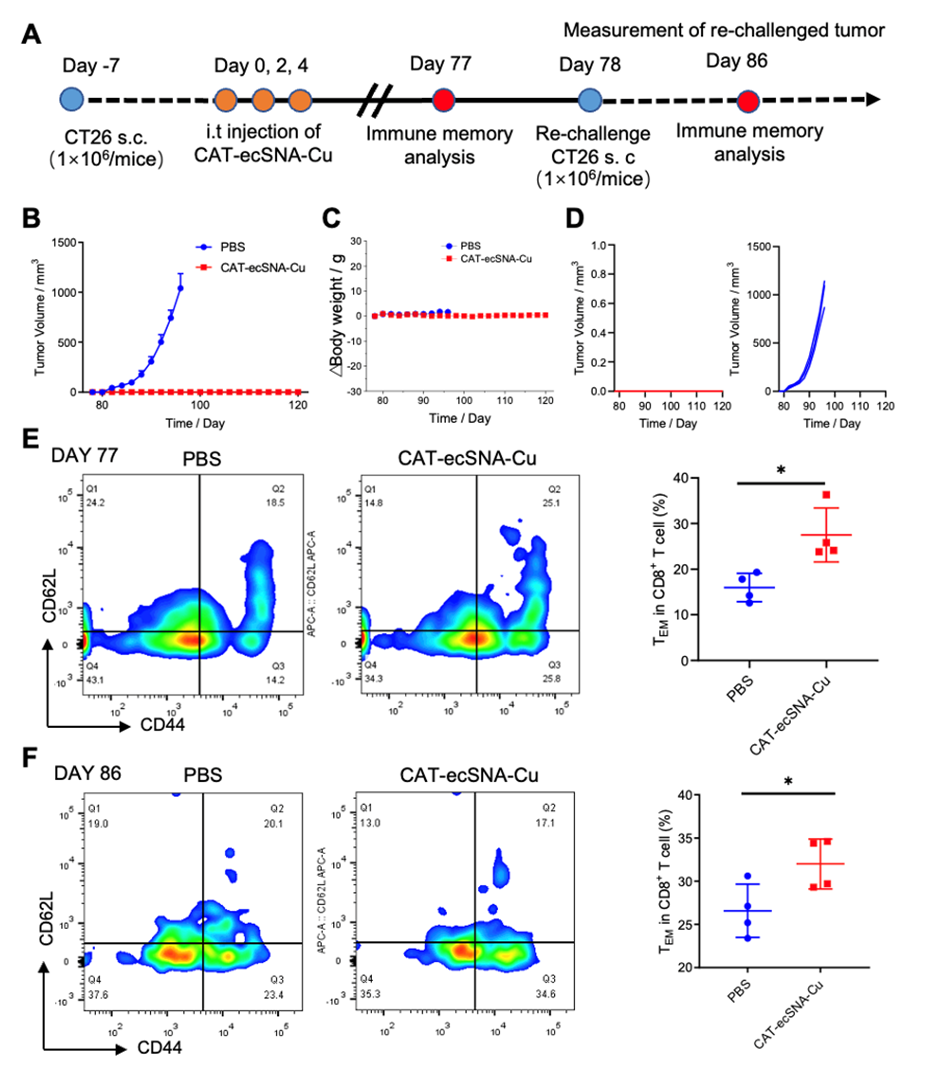
图5. 评估CAT-ecSNA-Cu增强铜死亡介导的长期免疫记忆效应。 在这项工作中,作者将RCA技术引入到SNA的构建中,并成功构建了基于铜的ecSNA(CAT ecSNA-Cu)。CAT-ecSNA-Cu的优异生物相容性表现出有效的细胞内铜离子输送和铜诱导的细胞铜死亡的过度积累。虽然CAT有效地改善了肿瘤缺氧微环境,但线粒体呼吸的增强进一步增强了铜死亡介导的肿瘤治疗。铜死亡诱导的细胞死亡可释放大量的DAMP,导致ICD的发生。在CAT通过抑制HIF-1α表达改善免疫抑制微环境和免疫佐剂polyCpG通过激活TLR-9受体促进DC成熟的情况下,抗原呈递能力和免疫反应显著增强。同时,铜死亡导致肿瘤细胞中PD-L1蛋白的上调,在与免疫检查点阻断剂αPD-L1的协同作用下,进一步增强铜死亡诱导的免疫反应,激活机体的长期免疫,有效抑制肿瘤转移和复发。总之,本文深入探讨了铜死亡与免疫治疗之间的联系,为开发基于铜死亡的治疗平台提供了新的视角。 论文信息: [1] Huang Y, Liu X, Zhu J, Chen Z, Yu L, Huang X, Dong C, Li J, Zhou H, Yang Y, Tan W. J. Am. Chem. Soc. 2024 Mar 29. https://doi.org/10.1021/jacs.3c14247
编辑:黄瑜婷
|